
| Meriones crassus[1] | |||
| Sundevall, 1842[2] | |||
 suwak tłusty Meriones crassus | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Podgromada | |||
| Infragromada | |||
| Rząd | |||
| Podrząd | |||
| Infrarząd | |||
| Nadrodzina | |||
| Rodzina | |||
| Podrodzina | |||
| Plemię | |||
| Rodzaj | |||
| Gatunek |
suwak tłusty | ||
| Synonimy | |||
| |||
| Kategoria zagrożenia (CKGZ)[12] | |||
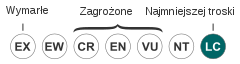 | |||
Suwak tłusty[13], dawniej także: myszoskoczka[14] (Meriones crassus) – gatunek gryzonia z podrodziny myszoskoczków w rodzinie myszowatych (Muridae), występujący w południowo-zachodniej części Palearktyki[15] – w północnej Afryce i południowej Azji[16]. Polska nazwa „myszoskoczka”[14] bywa używana także dla określenia innych gatunków – suwaka pustynnego (Meriones meridianus)[17] oraz myszoskoczki małej (Gerbillus gerbillus)[18].
Suwak tłusty został po raz pierwszy opisany w 1842 roku przez kuratora Muzeum Historii Naturalnej w Sztokholmie, profesora zoologii na Uniwersytecie w Lund Carla Sundevalla w pracy „Om Professor J. Hedenborgs insamlingar af däggdjur i Nordöstra Africa och Arabien”[19]. W 1919 brytyjski zoolog Oldfield Thomas opisał poszczególne gatunki rodzaju Meriones i dokonał podziału systematycznego[20].

M. crassus jest myszoskoczką należącą do rodzaju Meriones. Pierwszą kompleksową rewizją systematyki rodzaju autorstwa Oldfielda Thomasa była praca Jamesa Chawortha-Mustersa i Johna Ellermana (1947)[21].
W 1972 roku Barry R. Koffler przedstawił podział gatunku M. crassus na 9 podgatunków o różnej typowej lokalizacji[15]:
Po przeprowadzonych w 2009 roku morfometrycznych badaniach czaszek suwaka tłustego[22] zoolodzy wykazali, że na podstawie różnic w budowie części bębenkowej kości skroniowej poszczególnych populacji można wyłonić dwa podgatunki:
Najbliższym krewnym tego gatunku jest suwak perski (Meriones persicus)[23].
Nazwa rodzajowa Meriones nawiązuje do mitologicznego wojownika Merionesa (grec. Μηριόνης), syna Molusa[24], zaś epitet gatunkowy pochodzi od łacińskiego crassus oznaczającego „gruby”, „ciężki”, co jest aluzją do ciężkiej budowy ciała[25][26]. Lokalne nazwy: arab. الجرد الحريرى, ang. sundevall’s jird, silky jird, little sand jird[27].
W 1968 roku Komisja Nazewnictwa Zwierząt Kręgowych Polskiego Towarzystwa Zoologicznego w publikacji Polskie nazewnictwo zoologiczne określała, że gatunek Meriones crassus nosi polską nazwę „myszoskoczka”[14]. Z czasem jednak oznaczenie „myszoskoczka” było też używane dla określania innych gatunków. Kazimierz Kowalski w pracy Ssaki, zarys teriologii (1971) przypisał tę nazwę gatunkowi Meriones meridianus[17], zaś Multimedialna encyklopedia PWN Edycja 2.0 (2008) oznaczyła tą nazwą myszoskoczkę małą (Gerbillus gerbillus)[18]. Nazwa „myszoskoczka” bywała także błędnie przypisywana innemu gatunkowi – suwakowi mongolskiemu. W wydanej w 2015 roku przez Muzeum i Instytut Zoologii Polskiej Akademii Nauk publikacji „Polskie nazewnictwo ssaków świata” gatunkowi nadano ostatecznie nazwę suwak tłusty, określając także nazwę „suwak” dla rodzaju tych gryzoni[13].
Garnitur chromosomowy suwaka tłustego tworzy 60 par chromosomów. Zoolodzy zwracają uwagę, że jest to cecha wyróżniająca M. crassus od innych gatunków z rodzaju Meriones[15].

Suwak tłusty jest gryzoniem o średniej wielkości (całkowita długość wraz z głową i ogonem: 205–290 mm) i lekkiej budowie ciała[27]. Masa ciała tych zwierząt (średnio 69,2 g) jest zmienna w cyklach rocznych – latem jest większa (77,6 ± 2,7 g), a w zimie mniejsza (60,7 ± 12,3 g)[28]. Długa i miękka sierść[29] części grzbietowej jest blado żółtobrązowa, lekko nakrapiana czarnymi przebarwieniami wzdłuż grzbietu. Części wewnętrzne łap są białe. Na policzkach sierść jest nieco jaśniejsza, wokół oczu widać blade, jaśniejsze plamy, za uszami plamy białe. Uszy umiarkowanej długości pokrywa rzadki biały włos. Długi ogon pokryty jest od wierzchu żółto-brązowym włosem, od spodu jest biały. Przednie części łap są nieowłosione. Pazury w kolorze bladym[27]. Główny element odróżniający suwaka M. crassus od innych Gerbilinae to ogon z dobrze rozwiniętą kępką czarnych włosów na końcu i pas ciemnej sierści wzdłuż linii grzbietowej[25]. Dymorfizm płciowy u suwaków wyraża się rozmiarami osobników obu płci – samce są większe od samic[30].
M. crassus ma uzębienie o charakterze hypsodontycznym, co oznacza zęby o krótkich korzeniach i masywnej koronie. Wzór zębowy suwaka tłustego:
| Część ciała | wymiar średni (Koffler, 1972) |
wymiar średni (Ranck, 1968) |
wymiar średni samców (Mendelssohn, 1999) |
zakres wymiarów samców (Mendelssohn 1999) |
wymiar średni samic (Mendelssohn, 1999) |
zakres wymiarów samic (Mendelssohn 1999) |
|---|---|---|---|---|---|---|
| tułów z głową (mm) | 150 | 134 | 120–155 | 139 | 105–170 | |
| ogon (mm) | 150 | 133 | 120–150 | 133 | 110–145 | |
| tylne łapy (mm) | 38 | 32 | 30–33 | 31 | 29–33 | |
| ucho (mm) | 17 | 15 | 11–20 | 15 | 12–17 | |
| czaszka (najdłuższy wymiar) (mm) | 36 | 39,9 | 38,3–42 | 40 | 38,3–42,1 | |
| masa ciała (g) | 86 | 63–100 | 72 | 51–110 |
Receptory słuchu suwaka tłustego są bardzo czułe[15].
Organizm suwaka tłustego jest dobrze przystosowany do życia w gorącym i suchym klimacie. Funkcje organizmu są nastawione na optymalizowanie gospodarki płynami. Gryzoń oddaje kał bardzo suchy, a mocz w postaci mocno zagęszczonej. Suwak nie poci się, a przed żarem słońca chroni się opuszczając norę tylko w nocy. Wodę pozyskuje z pokarmu[27].
Suwak tłusty potrafi dobrze gospodarować trudnym do zdobycia pożywieniem[31]. Osiąga to dzięki wysokiej zdolności do trawienia materiałów suchych roślin, niskiemu tempu metabolizmu oraz zdolności do zatrzymywanie pokarmu w przewodzie pokarmowym – głównie w kątnicy[32].
Suwak tłusty jest wśród gatunków rodzaju Meriones najlepiej przystosowana do życia w suchym klimacie i przetrwania najbardziej niesprzyjających okresów[33]. Zoolodzy zaobserwowali, że M. crassus może przetrwać w niewoli przez wiele miesięcy bez dostępu do wody, otrzymując pożywienie w postaci suchej karmy[25]. Szybko reaguje na zmiany warunków siedliskowych i bez problemu zmienia miejsce pobytu nie wykazując wtedy przywiązania terytorialnego. Myszoskoczki te potrafią dopasowywać rozpoczęcie cyklu rozrodczego do pór roku i panujących warunków atmosferycznych. W przetrwaniu pomaga im także samotniczy tryb życia lub życie w bardzo małych koloniach, co pozwala na łatwiejsze gospodarowanie szczupłymi zasobami pożywienia[33].
Owo specyficzne przystosowanie gatunku zwróciło uwagę fizjologów i dlatego suwaki tłuste często były wykorzystywane do badań fizjologicznych[30][33][34][35][32][36]. Oceniano tempo ubytku masy ciała zwierząt utrzymywanych bez dostępu do wody. Suwaki tłuste w badanej przez naukowców hodowli utrzymywane na suchej diecie przez miesiąc utraciły tylko 5% swojej masy ciała[15]. Naukowcy stwierdzili także, że suwaki tłuste rozmnażały się w hodowli tylko wtedy, gdy miały dostęp do treściwego i soczystego pożywienia[25].
Suwak tłusty prowadzi nocny tryb życia[12][37]. Funkcjonuje w małych koloniach, ale może też wieść życie samotnicze[38][27]. Stadny tryb życia jest odnotowywany w okresach większej dostępności pożywienia[27]. Poszczególni naukowcy przedstawiają odmienne tezy na temat socjalnego trybu życia gatunku. David Harrison (1972)[39] oraz Haim i Tchernov (1974)[40] twierdzą, że suwak tłusty jest gatunkiem socjalnym, żyjącym w koloniach po 8–10 osobników[25]. Z kolei naukowcy, którzy w późniejszych latach badali populację tych suwaków w Negew, stwierdzili wyraźne cechy samotnicze[33]. Badający w 1999 roku izraelskie populacje suwaków Mendelssohn i Yom-Tov[25] także odnotowali, że na badanym terenie spotykali tylko pojedyncze osobniki, żyjące samotnie w danej okolicy. W literaturze zoologicznej spotykany jest też pogląd, że tezy o stadnym charakterze suwaków mogły wynikać z obserwacji pary z młodymi, przed ich usamodzielnieniem[25].

Suwaki tłuste mogą rozmnażać się przez cały rok[27], choć badacze zwracają uwagę, że okres lęgowy trwa zwykle od listopada do czerwca. W ciągu 1 roku samica może urodzić do trzech miotów, liczących około 3 do 7 młodych[27][33], albo – według innych źródeł – od 1 do 5 (średnio 3,3)[12], lub 2–6[41]. Małe suwaki rodzą się nagie, ślepe i nie są samodzielne[27]. Mają długie wibryssy[15]. Obserwacje przeprowadzone przez izraelskich zoologów podczas 16 ciąż suwaków wykazały, że czas trwania ciąży wynosił od 18 do 22 dni (średnio 19,7). Liczba młodych w miotach wahała się od trzech do siedmiu (średnia 4,9)[33]. Wcześniejsi badacze odnotowywali dłuższe czasy trwania ciąży – 23–25 dni[42] czy nawet do 31 dni[34]. Masa ciała młodych M. crassus wynosi średnio 3,35 g[43]. Małżowina uszna młodych otwiera się w piątym dniu życia, sierść na grzbiecie pojawia się pomiędzy 10 a 12 dniem, zaś na części brzusznej w 12–15 dniu. Wtedy też młode zaczynają stosować pierwsze zabiegi pielęgnacyjne futerka. Oczy otwierają się między 17 a 20 dniem życia. Stały pokarm młode zaczynają spożywać między 17 a 23 dniem[33]. Pod opieką matki pozostają do około 30 dnia życia, a po tym okresie usamodzielniają się i opuszczają gniazdo. Płodność mogą osiągać już po około 53 dniach od narodzin[27], ale średni wiek uzyskania płodności jest nieco wyższy i prawdopodobnie zróżnicowany dla przedstawicieli obu płci. Młode samice mogą być płodne wcześniej (po 61 dniach) niż ich bracia (średnio po 82 dniach)[43]. Dolna odnotowana granica płodności to 53 dni (samica) i 58 dni (samiec)[15]. Matka młodych jest płodna zaraz po porodzie[27].
Najwięcej miotów stwierdza się w okresie od marca do września. Suwaki tłuste starają się odchować młode przed nastaniem okresu, w którym zdobycie pożywienia staje się trudniejsze. Równocześnie jesienią odnotowuje się ostatnie ciąże w danym roku: w Izraelu, Omanie i Egipcie we wrześniu, ale w Iranie obserwowano pojawianie się młodych nawet w listopadzie i grudniu. Te różnice mogą wynikać z odmienności procesów fitofenologicznych roślinności[33]. Proporcje płci 1:1. Nie stwierdzono sezonowości w proporcji[33].
M. crassus wykazuje dużą żywotność. Podczas badania długości życia członków jednej kolonii liczącej 20 osobników stwierdzono, że po pół roku żyło 70%, po roku 20%, a po 1,5 roku 10% suwaków. Dwa osobniki z grupy, która przeżyła ponad 1,5 roku, były dorosłe już na początku badań[33]. W sprzyjających warunkach żywieniowych kolonia może się gwałtownie rozrastać. Suwaki tłuste żyją na wolności około 2 lat, a w niewoli do 3[33] lub do około 5 lat[27].
W niewoli suwaki tłuste mogą się rozmnażać we wszystkich porach roku[15]. Liczebność miotu określana w hodowli mieściła się w nieco niższym przedziale – od 1 do 4 młodych. Różnice mogą być skutkiem różnych parametrów funkcjonowania zwierząt w laboratoriach[33].
M. crassus komunikują się za pomocą różnych dźwięków głosowych, a także przez tupanie tylnymi kończynami[27].
Badania przeprowadzone na populacji z pustyni Negew wykazały, że suwak tłusty spędza stosunkowo dużo czasu w pobliżu swojej nory, ale później migruje na 3–7 dni do innej nory, oddalonej średnio o 47 m (zakres 5–140 m), gdzie zatrzymuje się na podobny okres[33][25]. Większość dobowej aktywności M. crassus spędza w norze. Na powierzchni przebywa jedynie po zmroku i spędza tam tylko 5–10% czasu dobowej aktywności[33].

Suwaki tłuste występują w południowo-zachodniej części Palearktyki[15]: w północnej Afryce od Maroka, przez Tunezję, Niger, Sudan, po Egipt, oraz w Azji – od Półwyspu Arabskiego na południu (Oman, Arabia Saudyjska), przez Izrael, Jordanię, Syrię po turecką Anatolię na północy oraz na terenie Iraku, Iranu i Afganistanu po zachodni Pakistan[16][12].
W południowym Izraelu jest najczęściej spotykanym gatunkiem gryzonia[44].
Suwak tłusty żywi się różnymi częściami roślin, w tym: nasionami, korzeniami, bulwami, liśćmi i owocami, a także owadami – szarańczą pustynną i świerszczami[27]. Samce zjadają także plewy[30]. M. crassus jest koprofagiem żerującym na odchodach osłów i wielbłądów. W poszukiwaniu pożywienia może się oddalać od nory nawet do 10 km[12], ale zawsze do niej wraca[27].
Suwak tłusty najchętniej zjada nasiona. Jednymi z chętniej spożywanych są nasiona łobody Atriplex halimus[45]. Pożywienie poszczególnych populacji jest zależne od składu gatunkowego i okresów wegetacji lokalnej flory. W porze letniej w Arabii suwaki chętnie żerują na akacjach, zjadają arbuz kolokwinta oraz osty. W Iranie badana kolonia zjadała nasiona poganka rutowatego rosnącego bezpośrednio nad norą. W Egipcie podczas penetracji nory znaleziono w niej fragmenty strączyńca ostrolistnego. Suwaki tłuste w Arabii Saudyjskiej i Kuwejcie zjadają nasiona lucerny, ale też szarańczę pustynną, świerszcze, korniki i szarańczę Anacridium aegyptium[15].
Na M. crassus pasożytuje wiele gatunków lokalnych pasożytów, najczęściej pchły Xenopsylla conformis i Xenopsylla ramesis[33][44][46], rzadziej pchły z gatunku Xenopsylla dipodilli[33]. Ponadto na suwakach tłustych pasożytują: Synosternus cleopatrae, Nosopsyllus theodori, Nosopsyllus pumilionis, Stenoponia tripectinata, Coptopsylla africana[25], wszy Polyplax paradoxa, kleszcze Rhipicephalus sanguineus, Hyalomma savignyi[33][25], roztocze Androlaelaps longipes, pierwotniaki z rodzajów Nuttallia i Graharnella oraz krętki Borrelia crocidurae[25]. U osobników badanych w Jordanii stwierdzono występowanie wiciowców z rodzaju Leishmania, które wywołują leiszmaniozę[12].
W Iranie M. crassus padają ofiarami sów[15].

M. crassus ma stosunkowo niewielkie wymagania siedliskowe. Można jednak odnotować, że istnieją wyraźne różnice w doborze siedliska w okresie letnim i zimowym. Decydują różne czynniki siedliskowe. W okresie lata, czyli w porze rozrodu, wybór pada na lokalizacje, gdzie w glebie występuje mała ilość skał i gliny, a teren jest obficie pokryty niskimi krzewami. W zimie suwak tłusty woli wybierać tereny z glebą o małej zawartości żwiru, a roślinność, mimo że skąpa, to ma stosunkowo wydatne organy spichrzowe. Od warunków glebowych zależy łatwość kopania nor oraz typ roślinności[33].
M. crassus żyjące w regionach pustynnych wybierają tereny suche, o rocznych opadach 30–100 mm[37]. Podstawowym siedliskiem tych zwierząt są pustynie piaszczyste[12], doliny sebha, solne wydmy[47] lub hamady[12][47]. Gryzonie te unikają terenów skalistych. Siedliska spotykane są do wysokości 1000 m n.p.m.[12]
W październiku i listopadzie gęstość zamieszkiwania jest wysoka na otwartych równinach i zboczach, zaś niska w ued. Odwrotna sytuacja ma miejsce w styczniu. Wynika to z okresowych migracji. Mierzony w cyklach rocznych poziom zagęszczenia jest zmienny i, w zależności od pory roku, wynosi 0,17–4,0 osobników na hektar[25].
Zoolodzy przeprowadzający badania izraelskich populacji M. crassus odnotowali regularne migracje. Jesienią (październik–listopad) suwak tłusty chętniej przebywał na otwartych przestrzeniach lub zboczach krateru (na pustyni Negew), niż w wyschniętych korytach rzek. Okresy jesiennych przeprowadzek pokrywały się z okresami wzmożonej wegetacji i kwitnięcia na równinach ulubionej potrawy: Hammada salicornica. Suwaki wracały do ued, bowiem tam wcześniej rozpoczyna się wegetacja roślin zielnych[33].
M. crassus spędza większość swojego życia w norze, kryjąc się przed wysoką temperaturą panującą w środowisku pustynnym. Struktura budowy nory jest zależna od typu gleby siedliska. W terenie piaszczystym budowane są nory bardzo proste, a w glebach cięższych, ilastych – rozbudowane[38]. Zazwyczaj nora suwaka tłustego ma jedno wejście[42], ale spotykano także systemy korytarzy o łącznej długości do 40 m, z osiemnastoma wejściami[27]. Wejścia do nory mają średnicę 4,5–8 cm[38], a korytarze biegną na głębokości około 1 metra poniżej poziomu terenu[27].
Nora jest wyposażona w komorę pełniącą funkcję spiżarni[42]. Jest ona zwykle wykopana blisko powierzchni terenu, ale komora gniazdowa, wyścielona materiałem roślinnym, ulokowana jest głębiej[27]. W spiżarni M. crassus gromadzi nasiona, co pozwala na zachowanie lub nawet zwiększenie ich wilgotności, bowiem nasiona wchłaniają parę wodną dzięki naturalnej wilgotności w norze[25].
Tunele mają średnicę 4,5–6 cm. Komora w terenie lessowym mierzy 10–12 cm. Ściany gniazda wyłożone są sianem na grubość 2–3 cm. Kilka badanych komór pełniło funkcję spiżarni. W terenach o gruncie piaszczystym budowa była wyraźnie prostsza. Często nory nie miały komór lub obserwowano w nich pseudo–komory, które były de facto fragmentami tuneli, poszerzonymi do średnicy 8–10 cm na odcinku 12–20 cm. Niektóre z nich miały cienką wyściółkę z siana – o grubości 0,5 cm[38]. M. crassus często buduje swoje nory pod krzewami, np. słonolubnymi Nitraria retusa[48]. Suwaki tłuste żerują w promieniu do około 80 m od nory[33].
| liczba badanych nor | długość tuneli w cm | liczba wejść do nory | maksymalna głębokość w cm | liczba komór | |
|---|---|---|---|---|---|
| tereny piaszczyste | 12 | 205–1000 | 2–5 | 30–60 | 0–2 |
| tereny lessowe | 9 | 300–1035 | 4–12 | 35–55 | 1–3 |
Średnia temperatura w badanych norach była wyższa niż średnia dobowa powietrza na powierzchni. W terenie piaszczystym była nieco wyższa niż w terenie lessowym. Z kolei średnia wilgotność powietrza w badanych norach była mniejsza od średniej wilgotności powietrza w terenie piaszczystym przez cały rok oraz występującej latem i jesienią w terenie lessowym[38].
| pomiar w norze | pomiar na powierzchni | |
|---|---|---|
| temperatura | 25–37 °C | 26–40 °C |
| wilgotność względna | 24–78% | 21,5–77% |
Czasami suwaki tłuste zamieszkują wspólne nory z myszami domowymi (Mus musculus), suwakami libijskimi (Meriones libycus) lub śródziemnomorskimi (Meriones shawi)[15]. Nory suwaka zostają też czasem zasiedlane przez skorpiony Androctonus amoreuxi[15].
Zoolodzy badający populacje w kraterze Ramon na izraelskiej pustyni Negew wyodrębnili sześć typów siedlisk[33]:
Północna część krateru Ramon leży na wysokości 900–1200 m n.p.m., zaś południowe tereny na poziomie około 510 m n.p.m. Klimat tej części pustyni Negew charakteryzuje się gorącymi, suchymi latami, ze średnią dobową temperaturą lipca na poziomie 34 °C, oraz stosunkowo chłodnymi zimami o średniej dobowej temperaturze w styczniu na poziomie 12,5 °C. Średnie opady na północnym krańcu krateru nie przekraczają 100 mm rocznie, zaś w centralnej jego części wynoszą średnio 56 mm[33].
M. crassus są używane jako zwierzęta laboratoryjne[44][50]. Hoduje się je także jako zwierzęta domowe[51][50].
Uczę się języka hebrajskiego. Tutaj go sobie utrwalam.
Zawartość tej strony pochodzi stąd.